
Les grands piliers de la fertilité ; chercher les solutions autrement (Partie 5)
Publié le 15 juin 2023
Écrit par Marik Péro, ND.A.

Publié le 15 juin 2023
Écrit par Marik Péro, ND.A.


PARTIE 5 : MÉTHYLATION ET ÉPIGÉNÉTIQUE
Voici déjà l’avant-dernier de cette série de six articles dédiés aux grands piliers de la fertilité, débutée en janvier dernier. Aujourd’hui, nous démystifierons un aspect majeur de la fertilité qui est probablement le plus connu, mais peut-être aussi le moins compris : la méthylation.
Oui, c’est ce que j’observe systématiquement dans ma pratique : à peu près toutes les femmes qui tentent de devenir enceintes ou qui le sont prennent un supplément de vitamine B9 sous forme d’acide folique. Pourquoi ? Parce que leur médecin leur en a prescrit, signe qu’il connaît l’importance de la méthylation, mais qu’il n’en comprend pas pleinement le fonctionnement biochimique. On sait tous que la vitamine B9 est indispensable pour la saine formation du tube neural de l’enfant à naître… Dans un sens, c’est vrai. Mais prise sous forme d’acide folique plutôt que de folate ou de 5-méthyltétrahydrofolate (5-MTHF), ce supplément peut nuire (considérablement) à la fertilité plutôt que l’aider.
C’est l’un des aspects les plus mal compris de la fertilité, et parmi les plus simples à rectifier. Qui plus est : même les futurs papas devraient en prendre avant et pendant le processus de procréation !
Pilier no 5 : Méthylation et épigénétique
Tout d’abord, qu’est-ce que l’épigénétique, et quel est son lien avec la méthylation ?
L’épigénétique est un processus de modulation de l’expression génétique qui ne change pas le génome d’un individu. En d’autres mots, c’est le phénomène par lequel l’organisme s’adapte à son environnement rapidement, sans avoir à changer son code génétique (ADN). L’épigénétique, c’est la bonne nouvelle que la science nous a apportée il n’y a pas si longtemps, nous confirmant que nos gènes ne sont pas une fatalité, car on a le pouvoir d’agir sur leur expression grâce à notre mode de vie (alimentation, sommeil, gestion de stress, pensées, qualité de l’environnement, etc.).
L’un des moyens de régulation de l’expression génétique est la méthylation, qui consiste en l’ajout d’un groupement méthyle (CH3) sur certaines bases de l’ADN ou sur les protéines qui l’entourent (histones). Cela a pour effet d’« allumer » ou d’« éteindre » certains gènes, selon les besoins de l’organisme.
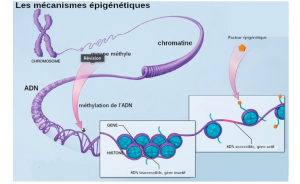
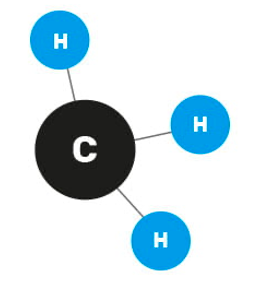
La méthylation est donc un processus métabolique vital, qui se déroule en permanence dans chacune de nos cellules. Elle est possible grâce à un groupe d’enzymes appelées les « méthyltransférases ». Ce sont elles qui, comme leur nom l’indique, transfèrent un groupement méthyle d’une molécule à une autre.
Le schéma ci-dessous illustre le cycle de la méthionine. C’est un peu complexe, mais crucial pour comprendre ce qui suit. La méthionine est un acide aminé qui a la capacité de former la S-Adénosyl-Méthionine (SAMe ou SAM) en se combinant avec une molécule d’ATP. Cette SAMe est une précieuse donneuse de CH3, qui vise à méthyler toutes sortes de molécules et de structures qui en dépendent pour leur intégrité (ADN, gaines de myéline, neurotransmetteurs comme la mélatonine, hormones, glutathion, etc. – même le fameux CoQ10 abordé dans mon deuxième article sur le pilier mitochondrial). À la suite de ce don de CH3, la SAMe devient S-Adénosyl-Homocystéine (SAH), puis simplement homocystéine en relâchant l’adénosine qu’elle avait préalablement acquise via l’ATP.
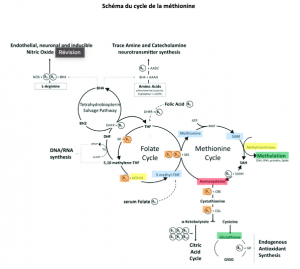
L’homocystéine ainsi obtenue ne doit idéalement pas s’accumuler dans les tissus et dans le sang, car elle possède une nature fortement pro-inflammatoire. Nous verrons un peu plus loin les dommages que son accumulation peut causer en contexte d’hypométhylation.
Puisque la nature fait toujours bien les choses, l’organisme dispose de trois voies métaboliques pour recycler l’homocystéine : celle des folates, celle de la choline ou encore celle du glutathion. Nous nous concentrerons sur la première, mais ferons un clin d’œil aux deux autres en abordant les solutions un peu plus loin.
C’est ici que le 5-MTHF et le cycle des folates prend toute son importance ; celui-ci donnera son groupement méthyle à une molécule de vitamine B12 (cobalamine), qui deviendra alors momentanément méthylcobalamine, avant de redonner immédiatement ce groupement méthyle à l’homocystéine grâce à l’enzyme méthionine synthase, qui dépend de la vitamine B2. Une carence en B9 méthylée (mais aussi en B12 ou en B2, et ultimement en pas mal n’importe quelle vitamine du groupe B) perturbe profondément ce cycle. Mais ce n’est pas tout. Le cycle des folates dépend également de la présence d’une enzyme qui porte un joli petit nom très facile à retenir… j’ai nommé la 5,10-méthylènetétrahydrofolate réductase ! Si ça ne vous fait rien, on va l’appeler la MTHFR pour la suite des choses ! C’est cette MTHFR, également dépendante de la vitamine B2, qui permet de redonner le 5-MTHF alimentant ces deux roues d’engrenage afin qu’elles puissent continuer à rouler rondement sans accumulation d’homocystéine.
Il est important de voir que ce n’est pas l’acide folique qui peut jouer ce rôle ! Si l’on observe bien le schéma, cette dernière doit préalablement subir trois activations enzymatiques pour prendre la forme 5-MTHF qui nous est utile ! Et comme nous le verrons ci-dessous, nous ne sommes pas tous égaux face à notre capacité d’effectuer ces conversions…
Quand la méthylation dérape…
Pour plusieurs raisons, la méthylation peut devenir sous-optimale.
En premier lieu, une alimentation pauvre en végétaux peut justifier le manque de ressources nécessaires (folates, cofacteurs) aux multiples réactions de méthylations cellulaires. Aussi, un déséquilibre digestif et/ou un intestin inflammé contribuent également à cet état carenciel qui ouvre la voie aux troubles de méthylation.
D’autres facteurs que nous ne détaillerons pas comme le stress, la consommation d’alcool, le tabagisme un long historique de prise de contraceptifs hormonaux ou de certains médicaments comme le Metformin ou les antiacides, par exemple, peuvent conduire à des troubles d’hypométhylation.
Il existe aussi la possibilité d’un polymorphisme génétique affectant l’efficacité de l’une ou l’autre des enzymes essentielles au bon déroulement des cycles du folate et de la méthionine. Effectivement, ces variations génétiques sont relativement fréquentes dans la population. Pour n’en nommer qu’un seul (mais il en existe plusieurs et on continue d’en découvrir), le polymorphisme C677T affectant l’enzyme MTHFR est présente chez près de 40 % des individus dans la population générale, et ce pourcentage est considérablement plus élevé chez les personnes souffrant d’infertilité. Sans freiner complètement les rouages de la méthylation, ces polymorphismes peuvent les ralentir au point de perturber considérablement des processus jugés comme non prioritaires pour la survie de l’organisme, comme… la fertilité !
Méthylation et fertilité
On comprend maintenant que la méthylation de l’ADN est cruciale dans un processus de divisions cellulaires accéléré tel que celui d’un développement embryonnaire. Les cellules souches de l’embryon sont modifiées via la méthylation pour former des tissus spécialisés (cœur, foie, cerveau, poumons, etc.). La méthylation est impliquée dans la fermeture du tube neural et donc son défaut peut conduire au spina bifida. Une méthylation qui ne fournit pas à soutenir le rythme effréné de ces mitoses mène inévitablement à l’arrêt du développement fœtal.
De plus, l’hyperhomocystéinémie engendrée par le ralentissement des cycles de la méthylation peut provoquer un stress oxydatif et une inflammation susceptible d’affecter les gamètes tant féminins que masculins, et tous les paramètres influant sur la fertilité du couple (fonction mitochondriale, thyroïdienne, circulatoire, etc.). L’endométriose peut même résulter de cette inflammation.
Voici donc en rafale les nombreuses conséquences possibles d’une hypométhylation en contexte de fertilité…
Comment savoir si cela me concerne ?
Il est possible de réaliser des tests pour détecter la présence de certains polymorphismes génétiques susceptibles d’affecter à la baisse la capacité du corps à effectuer ses réactions de méthylation. Le milieu médical attend généralement la troisième fausse-couche avant de proposer ces tests… Toutefois, certains laboratoires privés les offrent également et peuvent permettre d’obtenir plus tôt des réponses précieuses qui permettent de prendre action plus rapidement et d’éviter potentiellement de lourds deuils.
Certains signes peuvent aussi être des indicateurs d’une capacité de méthylation qui n’est pas optimale :
Le côté sombre de l’acide folique
Quand on vous prescrit de l’acide folique, il s’agit en fait de la forme synthétique de la vitamine B9, fabriquée en laboratoire, inexistante dans la nature. La forme naturelle, présente dans les végétaux, mais inactive, c’est la forme folate. Celle que le corps peut utiliser, qui est active, c’est la forme 5-MTHF.
Le problème, c’est que tout le monde prend de l’acide folique sans se poser de questions, alors que celle-ci est inactive. Par contre, elle a la même affinité que le 5-MTHF pour les récepteurs de folates, donc elle s’y installe et bloque les récepteurs, empêchant les folates et le 5-MTHF d’entrer dans les cellules ! Ainsi, l’acide folique a littéralement le potentiel de bloquer la méthylation… ! Donc, non seulement on ne devrait pas se supplémenter en acide folique (plutôt en folate ou MTHF), mais en plus, on devrait éviter les aliments sur le marché qui sont enrichis en acide folique.
Soutien concret à la méthylation
Qu’il y ait polymorphisme génétique ou non, il existe des solutions pour huiler les engrenages de ces cycles indispensables.
L’alimentation regorge de folates naturels que le corps peut aisément utiliser. La principale source ? TOUS les feuillus verts ! D’ailleurs, le mot « folate » vient du latin « folium », qui veut dire « feuilles ». Assurer ses apports en folate, ça passe d’abord et avant tout par une alimentation riche en verdures (brocoli, épinards, laitue romaine, fenouil, asperges, avocats, etc.). On en trouve également dans les betteraves, le foie bio, les noix et graines, les légumineuses, les œufs et la levure nutritionnelle.
Il est important également de consommer des aliments riches en composés soufrés pour optimiser la méthylation des folates : ail, oignon, crucifères (choux, navet…), jaunes d’œuf et poissons en sont de bons exemples.
On peut aussi intégrer des sources alimentaires d’autres donneurs de méthyle, comme la choline (œufs, saumon, morue, abats comme le foie bio, tofu, quinoa, brocoli, chou-fleur, légumineuses, noix, etc.) ou le triméthylglycine – TMG (betterave, quinoa, épinards, germe de blé).
Si un test génétique réalisé en lien avec un objectif de fertilité confirme la présence d’un trouble de la méthylation, une supplémentation s’impose. Un bon complexe de soutien à la méthylation devrait offrir :
Personnellement, je préfère les formules qui offrent un complexe B entier, puisqu’on sait que ces vitamines travaillent en synergie et qu’un équilibre entre elles est nécessaire.
On pourrait également rechercher les minéraux qui servent de cofacteurs aux enzymes impliqués dans les cycles de la méthionine et des folates, tels que zinc, manganèse, magnésium, etc.
Pour certaines personnes, il pourrait être pertinent de supplémenter directement en méthionine ou en SAMe. Puisque la méthylation permet aussi la synthèse de glutathion, antioxydant majeur de l’organisme, supplémenter directement en glutathion liposomal peut permettre d’équilibrer les voies vers la synthèse de SAMe également.
Attention toutefois ; la surméthylation est tout aussi problématique que l’hypométhylation ! Toute supplémentation devrait être prise sous les conseils d’un professionnel de la santé compétent en la matière.
