
Malaises inexplicables, et si c’était le syndrome post-COVID ?
Publié le 7 mai 2022
Écrit par Chantal Ann Dumas, ND.A.

Publié le 7 mai 2022
Écrit par Chantal Ann Dumas, ND.A.

Nous le savons maintenant, la COVID-19 consiste principalement en une maladie virale respiratoire causée par le virus SARS-CoV-2. Cependant, ladite infection est maintenant plutôt considérée comme une maladie systémique en raison des manifestations cliniques à large spectre impliquant plusieurs organes[i].
Les complications immédiates de la COVID sont bien définies et souvent associées à une augmentation de la mortalité, alors que les complications retardées ou à long terme sont de plus en plus reconnues et associées, pour leur part, à un accroissement de la morbidité[ii]. Puisque la réplication du virus cesse normalement environ quatre semaines après l’infection initiale, pourquoi certaines personnes continuent-elles d’éprouver des symptômes et surtout, en quoi consiste le syndrome post-COVID ?
Selon l’Organisation mondiale de la santé (OMS) : « L’état post-COVID-19 survient chez les personnes ayant des antécédents d’infection probable ou confirmée par le SARS-CoV-2, généralement trois mois après le début de la COVID-19 avec symptômes et qui durent au moins deux mois et ne peuvent pas être expliqués par un autre diagnostic[iii]. » Les symptômes courants comprennent la fatigue, l’essoufflement, le dysfonctionnement cognitif, etc., et ont généralement un impact sur la vie quotidienne de la personne.
Il est toutefois important de noter qu’un syndrome consiste en un ensemble de plusieurs symptômes ou signes en rapport avec un état pathologique donné[iv], alors ces symptômes peuvent ne pas tous être présents ou se combiner de différentes façons. Ils peuvent apparaître après le rétablissement d’un épisode aigu de COVID-19 ou persister après la maladie initiale, ils peuvent également fluctuer ou réapparaître au fil du temps.
Quant à l’incidence du syndrome post-COVID, elle est estimée à 10-35 %, mais elle peut atteindre 85 % chez les personnes qui ont été hospitalisées[v].
Tableau des symptômes :
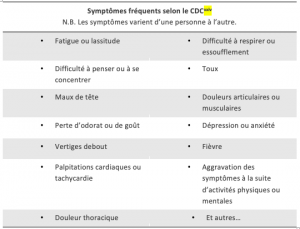
Chippa V, Aleem A, Anjum F. Post Acute Coronavirus (COVID-19) Syndrome. [Updated 2021 Dec 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available from https://www.ncbi.nlm.nih.gov/books/NBK570608
On ne sait pas encore exactement ce qui cause ce syndrome. Plusieurs théories ont été émises, y compris celle de la réponse auto-immune avec inflammation généralisée. Selon cette dernière, il y aurait une incapacité du système immunitaire à se réinitialiser après le stade actif de l’infection initiale et en plus de l’inflammation systémique générée par la COVID-19, il y aurait une réponse auto-immune qui serait déclenchée[vi].
D’autres chercheurs proposent la théorie de la persistance virale et des fantômes viraux, qui suggère que le virus ou l’ARN viral pourraient persister au sein des cellules mobiles et se propager dans tout le corps longtemps après l’infection initiale et entraîner une réponse immunitaire activée ainsi qu’un état inflammatoire chronique. Cela expliquerait, selon eux, la diversité des symptômes[vii]. L’activation d’autres agents pathogènes dormants qui profitent de l’attaque du système immunitaire sur le SARS-CoV-2 pourrait aussi être en cause[viii].
Il semble que le virus SARS-CoV-2 pourrait même utiliser l’énergie de nos mitochondries au profit de la réplication virale, les laissant à plat, et nous aussi ! Il existe quelques autres théories trop complexes pour le cadre de cet article, mais celle qui me semble la plus plausible selon mes observations cliniques et mes recherches est celle du chevauchement de plusieurs affections[ix].
Un syndrome complexe
Voici quelques-uns des phénomènes que j’ai observés chez la majorité des personnes affectées par le syndrome post-COVID, mais rappelons-nous que chaque cas est unique et peut présenter plusieurs aspects alors que ce ne sera pas le cas pour d’autres.
Il a été beaucoup question de la fameuse tempête de cytokines chez les personnes infectées. Cela peut survenir parce que le SARS-CoV-2 a la capacité de stimuler une partie de la réponse immunitaire innée appelée « inflammasome NLRP3 »[x].
Les inflammasomes sont des complexes multiprotéiques localisés dans le cytoplasme de la cellule qui sont responsables de la maturation des cytokines pro-inflammatoires telles que l’interleukine 1 bêta (IL-1β), l’une des principales cytokines pro-inflammatoires qui régulent un large éventail de réponses immunitaires[xi].
Il a été largement démontré que la réponse inflammatoire excessive est impliquée dans plusieurs maladies auto-immunes, métaboliques et neurodégénératives[xii].
L’activation et l’infiltration des cellules immunitaires pendant la réponse inflammatoire entraînent une production accrue de radicaux libres tels que les espèces réactives de l’oxygène (ROS) qui peut déclencher l’inflammasome NLRP3, lui-même générateur de radicaux libres[xiii]. Les radicaux libres hautement réactifs tels que les ROS endommagent la membrane cellulaire, les protéines et l’ADN, ce qui déclenche une cascade inflammatoire autopropagatrice d’événements dégénératifs[xiv].
Ce cercle vicieux rompt l’équilibre redox entre la production de radicaux libres et nos antioxydants[xv] et peut entraîner des carences en antioxydants[xvi].
Les mitochondries sont nos centrales de production énergétique qui fabriquent constamment notre adénosine triphosphate (ATP), mais ce faisant, elles produisent aussi des ROS. Des concentrations élevées de ROS peuvent altérer la capacité des mitochondries à synthétiser notre ATP et à remplir leur large éventail de fonctions métaboliques[xvii]. De plus, les ROS peuvent causer de graves dommages aux membranes cellulaires et organites, à l’ADN et aux protéines de la mitochondrie[xviii].
La défense immunitaire suscitée par des maladies virales telles que la COVID sollicite le système de défense antioxydant de l’hôte[xix] tout comme le stress oxydant accru. Des antioxydants comme le glutathion (GSH) qui joue un rôle crucial dans la défense contre les dommages induits par les ROS et qui est également impliqué dans la régulation de diverses voies métaboliques essentielles telles que la défense antivirale, le maintien de la fonction mitochondriale et la désintoxication des médicaments notamment, peuvent se retrouver en état de carence[xx]. Cette carence affectera en retour tous les processus physiologiques susmentionnés.
Un autre exemple est le zinc, un micronutriment essentiel impliqué dans la régulation des réponses immunitaires et dont le taux chute durant les infections, y compris l’infection par le SARS-CoV-2[xxi]. La carence en zinc est connue pour induire l’anosmie et l’agueusie (perte d’odorat et de goût) fréquemment rencontrées durant la COVID[xxii].
Le manque de zinc fragilisera en retour le système immunitaire et pourra prédisposer la personne à des infections subséquentes comme dans le cas du syndrome post-COVID.
Les associations entre la composition du microbiote intestinal, les niveaux de cytokines et les marqueurs inflammatoires chez les patients atteints de COVID-19 suggèrent que le microbiome intestinal est impliqué dans l’ampleur de la gravité de la COVID-19, peut-être en modulant les réponses immunitaires de l’hôte. La dysbiose du microbiote intestinal après la résolution de la maladie pourrait contribuer à des symptômes persistants de la COVID-19[xxiii].
Conclusion
Le syndrome post-COVID constitue le parfait exemple de ces « nouvelles maladies » qu’on appelle « syndrome », puisqu’elles se distinguent par un ensemble de symptômes variables et apparemment disparates touchant différents systèmes. La médecine conventionnelle dans sa grande précision tend à perdre de vue l’interaction entre les différents systèmes, et ses outils de pointe n’ont malheureusement souvent pas grandes solutions à offrir pour ce type de trouble multifactoriel.
Heureusement, c’est justement dans ce contexte que la naturopathie avec son arsenal thérapeutique excelle ! Dans mon prochain article, je vous parlerai des plantes ayant un large spectre d’action englobant plusieurs des dysfonctionnements abordés ainsi que des vitamines et minéraux ayant le potentiel de soutenir le rétablissement des dysfonctions observées dans le syndrome post-COVID.
RÉFÉRENCES :
[i] Chippa V, Aleem A, Anjum F. Post Acute Coronavirus (COVID-19) Syndrome. [Updated 2021 Dec 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK570608
[ii] Chippa V, Aleem A, Anjum F. Post Acute Coronavirus (COVID-19) Syndrome. [Updated 2021 Dec 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK570608
[iii][iii] World Health Organization. A clinical case definition of post COVID-19 condition by a Delphi consensus. Published October 6, 2021. https://www.who.int/publications/i/item/WHO-2019-nCoV-Post_COVID-19_condition-Clinical_case_definition-2021.1
[iv] Larousse en ligne. https://www.larousse.fr/dictionnaires/francais/syndrome/76170
[v] Pavli A, Theodoridou M, Maltezou HC. Post-COVID Syndrome: Incidence, Clinical Spectrum, and Challenges for Primary Healthcare Professionals. Arch Med Res. 2021 Aug;52(6):575-581. doi: 10.1016/j.arcmed.2021.03.010. Epub 2021 May 4. PMID: 33962805; PMCID: PMC8093949.
[vi] Gaebler C, Wang Z, Lorenzi JCC, et al. Evolution of Antibody Immunity to SARS-CoV-2. bioRxiv [Preprint]. 2021 Jan 4:2020.11.03.367391. doi: 10.1101/2020.11.03.367391. Update in: Nature. 2021 Mar;591(7851):639-644. PMID: 33173867; PMCID: PMC7654855.
[vii] Amato, V. (2020, September 09). Long haulers: The casualties of COVID-19. Consulté le 14 février 2022 https://www.hmpgloballearningnetwork.com/site/emsworld/article/1224834/long-haulers-casualties-covid-19
[viii] Belluz, J. (2021, April 14). Scientists haven’t figured out long COVID. Here are 5 of their best hypotheses. https://www.vox.com/22369734/long-hauler-covid-vaccine.
[ix] Mahase, E. (2020). Long COVID could be four different syndromes, review suggests. BMJ, M3981. doi:10.1136/bmj.m3981.
[x][x] Evans, J. M., Luby, R., Lukaczer, D., Rountree, R., Stone, P. M., Guilliams, T. G., Yanuck, S., Messier, H., Ramsdell, K., & Hanaway, P. J. (2020). The Functional Medicine Approach to COVID-19: Virus-Specific Nutraceutical and Botanical Agents. Integrative medicine (Encinitas, Calif.), 19(Suppl 1), 34–42.
[xi] Evans, J. M., Luby, R., Lukaczer, D., Rountree, R., Stone, P. M., Guilliams, T. G., Yanuck, S., Messier, H., Ramsdell, K., & Hanaway, P. J. (2020). The Functional Medicine Approach to COVID-19: Virus-Specific Nutraceutical and Botanical Agents. Integrative medicine (Encinitas, Calif.), 19(Suppl 1), 34–42.
[xii] Evans, J. M., Luby, R., Lukaczer, D., Rountree, R., Stone, P. M., Guilliams, T. G., Yanuck, S., Messier, H., Ramsdell, K., & Hanaway, P. J. (2020). The Functional Medicine Approach to COVID-19: Virus-Specific Nutraceutical and Botanical Agents. Integrative medicine (Encinitas, Calif.), 19(Suppl 1), 34–42.
[xiii] Abais, J. M., Xia, M., Zhang, Y., Boini, K. M., & Li, P. L. (2015). Redox regulation of NLRP3 inflammasomes: ROS as trigger or effector?. Antioxidants & redox signaling, 22(13), 1111–1129. https://doi.org/10.1089/ars.2014.5994
[xiv] Ashok, A., Andrabi, S. S., Mansoor, S., Kuang, Y., Kwon, B. K., & Labhasetwar, V. (2022). Antioxidant Therapy in Oxidative Stress-Induced Neurodegenerative Diseases: Role of Nanoparticle-Based Drug Delivery Systems in Clinical Translation. Antioxidants (Basel, Switzerland), 11(2), 408. https://doi.org/10.3390/antiox11020408
[xv] Kurutas EB. The importance of antioxidants which play the role in cellular response against oxidative/nitrosative stress: current state. Nutr J. 2016 Jul 25;15(1):71. doi: 10.1186/s12937-016-0186-5. PMID: 27456681; PMCID: PMC4960740.
[xvi] Sánchez-Rodríguez, M. A., & Mendoza-Núñez, V. M. (2019). Oxidative Stress Indexes for Diagnosis of Health or Disease in Humans. Oxidative medicine and cellular longevity, 2019, 4128152. https://doi.org/10.1155/2019/4128152
[xvii] Murphy M. P. (2009). How mitochondria produce reactive oxygen species. The Biochemical journal, 417(1), 1–13. https://doi.org/10.1042/BJ20081386
[xviii] Giorgi, C., Marchi, S., Simoes, I., Ren, Z., Morciano, G., Perrone, M., Patalas-Krawczyk, P., Borchard, S., Jędrak, P., Pierzynowska, K., Szymański, J., Wang, D. Q., Portincasa, P., Węgrzyn, G., Zischka, H., Dobrzyn, P., Bonora, M., Duszynski, J., Rimessi, A., Karkucinska-Wieckowska, A., … Wieckowski, M. R. (2018). Mitochondria and Reactive Oxygen Species in Aging and Age-Related Diseases. International review of cell and molecular biology, 340, 209–344. https://doi.org/10.1016/bs.ircmb.2018.05.006
[xix] Polonikov A. (2020). Endogenous Deficiency of Glutathione as the Most Likely Cause of Serious Manifestations and Death in COVID-19 Patients. ACS infectious diseases, 6(7), 1558–1562. https://doi.org/10.1021/acsinfecdis.0c00288
[xx] Polonikov A. (2020). Endogenous Deficiency of Glutathione as the Most Likely Cause of Serious Manifestations and Death in COVID-19 Patients. ACS infectious diseases, 6(7), 1558–1562. https://doi.org/10.1021/acsinfecdis.0c00288
[xxi] Wessels I, Rolles B, Rink L. The Potential Impact of Zinc Supplementation on COVID-19 Pathogenesis. Front Immunol. 2020 Jul 10;11:1712. doi: 10.3389/fimmu.2020.01712. PMID: 32754164; PMCID: PMC7365891.
[xxii] Equils O, Lekaj K, Wu A, Fattani S, Liu G, Rink L. Intra-nasal zinc level relationship to COVID-19 anosmia and type 1 interferon response: A proposal. Laryngoscope Investig Otolaryngol. 2020 Dec 25;6(1):21-24. doi: 10.1002/lio2.513. PMID: 33614925; PMCID: PMC7883601.
[xxiii] Yeoh YK, Zuo T, Lui GC, et al. Gut microbiota composition reflects disease severity and dysfunctional immune responses in patients with COVID-19. Gut. 2021 Apr;70(4):698-706. doi: 10.1136/gutjnl-2020-323020. Epub 2021 Jan 11. PMID: 33431578; PMCID: PMC7804842.
[xxiv] Centers for Disease Control and Prevention. Post-COVID conditions. https://www.cdc.gov/coronavirus/2019-ncov/long-term-effects/index.html?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fcoronavirus%2F2019-ncov%2Flong-term-effects.html
